Dimitri Ivanovich Mendeleje
Padre de la Tabla periódica
LOS ELEMENTOS Y EL LENGUAJE DE LA QUÍMICA
Cada elemento químico se distingue de los otros porque sus propiedades son diferentes; esas propiedades están dadas por la forma con que se encuentran constituidos. Una propiedad común a todos los elementos es la reactividad química. Esta propiedad se refiere a la facilidad con la que reacciona un elemento con otros elementos. Por ejemplo, la rapidez con que se oxidan. Algunos elementos se oxidan muy fácilmente como el sodio y el potasio; en cambio el oro es muy difícil de oxidar. Algunas propiedades físicas de los elementos son el estado de agregación y el color. El estado de agregación se refiere al estado físico. Por ejemplo, la gran mayoría de los elementos se encuentran en estado sólido; ejemplos son, el oro, aluminio y el hierro. Otros, se encuentran en estado gaseoso: oxígeno, nitrógeno, hidrógeno, flúor, cloro, helio, neón, etc. Son cinco los líquidos. bromo, cesio, francio, galio y mercurio. Existe una amplia variedad de colores entre los elementos que van desde incoloros, como los gases oxígeno e hidrógeno, pasando por los amarillentos como el cloro; los rojizos como el bromo y negro como el carbono.
De los más de 109 elementos que se encuentran clasificados hasta ahora, 92, existen en la naturaleza; los demás son artificiales o sintéticos, es decir, se han obtenido por métodos artificiales. Los elementos después del elemento 92, el uranio, se denominan transuránicos.
Para comunicarnos en forma efectiva los seres humanos, utilizamos, el lenguaje que es comprendido fácilmente tanto por el que lo emite como por el que lo recibe. El lenguaje de la Química ha tenido un desarrollo paralelo al de sus descubrimientos y aplicaciones. Los primeros que utilizaron un lenguaje escrito en sus experiencias fueron los alquimistas. Y así, fue como inventaron una serie de misteriosos símbolos, tomados la mayoría de la mitología griega y de la astrología. Por ejemplo, el hierro, llegó a representarse como la lanza y el escudo de Marte; el oro se simbolizaba con el sol. El cobre, como el espejo de Venus. Estos símbolos eran difíciles de interpretar, además de que un mismo elemento recibía varios símbolos, como el mercurio que llegó a tener 20 símbolos diferentes.
Símbolos químicos de los alquimistas
,,,,,,,,,kk
Al difundirse la alquimia en Europa, en la Edad Media, estos símbolos terminaron perdiéndose entre los símbolos personales que se crearon con el fin de ocultar su significado en los textos sobre Alquimia y darle su carácter mágico y misterioso.
Conforme pasaba el tiempo, los científicos que estudiaban la naturaleza se dieron cuenta de que era muy importante escribir el resultado de sus experimentos para que otras personas pudieran entenderlos. A continuación algunos símbolos que se utilizaron
Símbolos para el el sulfuro de mercurio
El primero en desarrollar un sistema práctico fue John Dalton, en 1809, quien se convenció de que cualquier reacción química podía presentarse por medio de figuras. Trató de unificar lo símbolos de tal manera, que con una representación se entendiera de qué elementos se trataba. Para ello, representó con círculos diferentes a cada elemento y con la unión de círculos los compuestos. A continuación la figura que los representa:
CLASIFICACIÓN PERIÓDICA DE LOS ELEMENTOS
Las primeras clasificaciones se hicieron en base a sus propiedades: carácter metálico o no metálico; propiedad de arder o no, combustibles o comburentes, etc. Otra clasificación se basó en el modo en que los elementos se conducen en la electrólisis (descomposición de un electrolito: ácido, base o sal, por el paso de la corriente eléctrica).
En 1817 Johan W. Dobereiner ordenó los 20 elementos conocidos en grupos de tres a los que llamó Tríadas, Veinte años después, en 1827, destacó la existencia de otras agrupaciones de tres elementos, que seguían una análoga relación entre sí.
Estos grupos eran:
Cloro, bromo y yodo
Azufre, selenio y telurio
Litio, sodio y potasio
Döbereiner hizo un intento de relacionar las propiedades y semejanzas químicas de los elementos y de sus compuestos, con las características atómicas de cada uno de ellos, que en ese caso se trataba de los pesos atómicos, viéndose un gran parecido entre ellos, y una variación progresiva y gradual desde el primero hasta el tercero o último de la triada.
En la clasificación de las triadas (ordenamiento de tres elementos), el químico alemán intentó explicar que el peso atómico medio de los elementos que se encuentran en los extremos de las triadas, es similar al peso atómico de los elementos que se encuentran en la mitad de la triada. Por ejemplo: la triada Cloro, bromo y Yodo, tiene respectivamente 36,80, y 127 respectivamente, en cuanto al peso atómico se refiere. Si realizamos la suma de los extremos, es decir 36+127 y a su vez, la dividimos entre 2, el resultado es 81, o lo que es lo mismo, un número próximo a 80, que casualmente es el número atómico del elemento del medio, es decir, del bromo, hecho que hace que encaje perfectamente en el ordenamiento de la triada.
En 1865, John Newlands, químico inglés, sugirió otra clasificación. Colocó los elementos en el orden ascendente de sus masas atómicas y notó que parecía haber una repetición en las propiedades cada ocho elementos. Por lo tanto, colocó los elementos conocidos en aquel entonces, en siete grupos de siete cada uno. (los gases nobles no se conocían en ese tiempo).
H, Li, Be, B, C, N, O, F, Na, Mg, Al, Si, P, S, Cl, K, Ca, Cr, Ti, Mn, Fe
Al observar con cuidado notó que el litio, el sodio y el potasio con propiedades físicas y químicas similares (se oxidan fácilmente al ponerse en contacto con el oxígeno del aire, reaccionan en forma violenta y explosiva con agua y arden vigorosamente en una atmósfera de cloro), se ubicaban a cada siete elementos. Entonces sorprendido con sus observaciones, revisó los metales alcalinotérreos berilio, magnesio y calcio, y encontró el mismo comportamiento. Así que examinó la posición de los halógenos flúor y cloro, lo que le permitió enunciar la Ley de la Octavas.
Propuesta de Newlands
En la tabla contigua, a la derecha, falta una octava columna con los elementos Flúor, Cloro y Bromo  |
|
El descubrimiento de Newlands no impresionó a sus contemporáneos, probablemente porque la periodicidad observada sólo se limitaba a un pequeño número de los elementos conocidos. Fue ridiculizado, al dejar algunos espacios en blanco para los elementos que aún no habían sido descubiertos. Los miembros de la Chemical Society de Londres se negaron a publicar su trabajo, aunque la idea ya había sido difundida en la revista Chemical News, lo que originó que Newlands renunciara a la investigación científica. Si bien el trabajo de Newlands fue incompleto, resultó de importancia, ya que puso en evidencia la estrecha relación existente entre los pesos atómicos de los elementos y sus propiedades físicas y químicas. Su tabla se considera como la primera antecesora de nuestra tabla periódica actual, por lo que fue premiado con la medalla Davy.
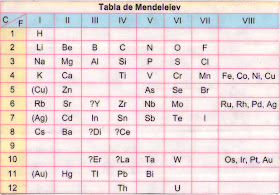
Mendelejev y su tabla periódica:
Basándose en la idea de Newlands, y relegando un poco la idea de un orden riguroso en la sucesión de los 63 elementos (descubiertos hasta ese momento) de acuerdo con sus pesos atómicos, en 1868 el químico ruso, Dimitri Ivanovich Mendeleiev (1834 – 1907) ideó una clasificación periódica de los elementos casi perfecta, que presentó en 1869 como Tabla de los Elementos, aunque el químico alemán Julius Lothar Meyer (1830 – 1895), en 1870, presentó una gráfica como forma de clasificar los elementos en la que colocación de los elementos estaban de acuerdo con su peso atómico y la relación de los pesos concordaba con otras propiedades que tenían los elementos clasificados.
Lothar Meyer encontró la solución al ordenar los elementos en función de sus números atómicos. Encontró que en el núcleo de cada elemento hay un número entero de cargas positivas, que es igual al número atómico (Z ). Al ordenar de esta manera los elementos, las propiedades del yodo y el telurio se ajustaban perfectamente en las columnas correspondientes. Este hecho se establece en la moderna ley periódica que propone “Las propiedades de los elementos son una función periódica de sus números atómicos”
En su tabla Mendeleiev colocó los elementos de acuerdo con el orden creciente de sus pesos atómicos relativos, de manera que los elementos con propiedades parecidas quedaban en el mismo grupo y dejó algunos espacios en blanco para los elementos que aún no habían sido descubiertos. En 1871 revisó nuevamente su tabla y clasificó ocho grupos de elementos colocándolos en columnas verticales, tomando en cuenta además la composición de los óxidos comunes que formaban.
Al construir su tabla notó que había cierto número de espacios vacíos entre los diferentes elementos. Sin embargo, en vez de considerar esto una imperfección, lanzó la hipótesis de que estas sustancias estaban todavía por descubrir. Estaba tan convencido de la validez de su idea que indicó con desconcertante precisión tres espacios vacíos que se encontraban entre el boro, aluminio y silicio. Estas tres casillas, dijo, correspondían a tres elementos desconocidos que bautizó como eka-boro, eka-aluminio y eka- silicio y predijo las características de esos tres elementos.
Estas ideas no fueron muy bien recibidas por sus colegas. Sin embargo, en 1875 un químico francés descubrió un mineral de cinc de los Pirineos, que llamó Galio en honor a Francia. Los análisis demostraron que las características de esa sustancia correspondían exactamente a las previstas por Mendeleiev para el eka-aluminio. Cuatro años después, un químico sueco, descubrió el escandio y luego, Winkler, un químico alemán separó al germanio. Resultaron ser el eka-boro y el eka-silicio, previstos por Mendeleiev.
Después del descubrimiento del protón, Henry G. Moseley, físico británico, estudió y determinó la carga nuclear de los átomos de los elementos y concluyó que los elementos se debían ordenar en base a sus números atómicos crecientes. En base a esto enunció “Las propiedades físicas y químicas de los elementos son funciones periódicas de los números atómicos”. De esta forma corrigió las discrepancias que existían en la tabla periódica.
Henry G. Moseley
La tabla periódica como la utilizamos actualmente, es la ordenación y clasificación de los elementos, según sus propiedades químicas, en grupos y periodos. Los grupos o familias están formados por los elementos que se encuentran en una columna (filas elementos que se encuentran en una columna (fila vertical) y se identifican, tradicionalmente, con números romanos. Los periodos son filas horizontales y se designan con números arábigos del 1 al 7. La tabla periódica incluye ocho grupos, divididos en dos subgrupos: los principales (A) y los secundarios (B), estos últimos están formados solamente por metales.
Diferentes modelos de tablas periódicas
Páginas relacionadas.
Nota: A continuación una presentación power point respecto al tema.
http://www.slideboom.com/presentations/417569/clasificacion_de_la_tabla_periodica_segun_la_c
VIDEOS RELACIONADOS
Material usado:
Historia de la Química: ING. MARCO ANTONIO SÓSOL MORGADO
http://www.cespro.com/Materias/MatContenidos/Contquimica/QUIMICA_INORGANICA/periodicidad_quimica.htm




























Me pueden escribir preguntas, en esta parte.
ResponderEliminarProfesora ¿Cuáles eran los videos que teníamos que observar? Noemí Mata 11J
ResponderEliminarPara poder verlos debes abrir esta página con mozilla Firefox. Saludos.
ResponderEliminarProfe Ya vi un par de videos pero hay algunos que no entiendo Rodolfo Núñez 11J
ResponderEliminarRodolfo entonces debes verlo nuevamente y con más detenimiento.
ResponderEliminar